Зависимость константы равновесия синтеза метанола от температуры и давления для реальных газов
Раздел: Наука
Е.С.Тимошин*, И.А.Бобыленков **, М.А.Назарян **, А.В.Тихов
* - ООО «Новгородский ГИАП», Великий Новгород;
** - ОГА ПОУ Новгородский химико-индустриальный техникум, Великий Новгород
E-mail: timoshin@vnov.acron.ru
Процесс образования метанола – равновесно-обратимый процесс. Основная реакции образования метанола - взаимодействие оксида и диоксида углерода с водородом - реакция обратима и экзотермична:
CO2+2H2=CH3OH+90, 73 кДж
Для расчета константы равновесия предложено следующее уравнение нормального сродства:
lgKp=3748,7/T-9,2833lgT+3,1475*10-3T-4,2613*10-7T2+13,8144 [1]
Следует заметить, что в работе [1] не уточняется размерность константы равновесия и при указании давления в МПа искомая константа равновесия имеет размерность атм-2 , что может ввести в заблуждение и повлечь за собой ошибку в два порядка. Значение Кр по данному уравнению будет соответствовать идеальным газам. При этом практически в промышленности синтез ведется при давлении порядка 50-100 атм. С повышением давления свойства реальных газов существенно отличаются от идеальных. Чем выше давление и ниже температура, тем менее вероятно идеальное состояние газовой смеси. Следовательно, при проведении химического процесса синтез метанола при повышенном давлении реакционную смесь нельзя считать идеальной. Для реальной газовой смеси коэффициенты летучести компонентов, характеризующие отклонение реальной смеси от идеальной, не равны единице. Поэтому для вычисления константы равновесия при повышенных давлениях применяют метод приведённых состояний. Константа равновесия реакции для состояния реальных газов связана со стандартной константой равновесия следующим соотношением:
Kp=K_f/K_ɣ [2]
Коэффициенты летучести веществ находят по принципу соответственных состояний, согласно которому значения γi считаются одинаковыми, если вещества находятся при одних и тех же приведённых температуре (τ=T/Tкр) и давлении (π=p/pкр). Критические параметры веществ находят в справочнике [3]. Мы использовали эмпирические графики зависимости коэффициентов летучести от приведенных критических параметров, а результаты расчета приведены в таблице.



Кγ (T)=ɣ_сн3он/(ɣ_со 〖*ɣ〗_н2^2 )

Логарифм константы равновесия:
lgKf=3748,7/T-9,2833lgT+3,1475*10-3T-4,2613*10-7T2+13,8144
Kf=10lgKp
Константа равновесия находили по уравнению:
Kp=K_f/K_ɣ [2]


Рис.1. Зависимость константы равновесия синтеза метанола от температуры и давления.
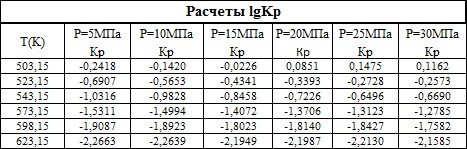

Рис.2. Зависимость десятичного логарифма константы равновесия синтеза метанола от температуры и давления.
Заметим, что в отличии от источников [1] нами взяты более узкие интервалы по температуре и давлению, т.к практически повсеместно низкотемпературный Zn-Cu катализатор работает в данном интервале.
Зависимость константы равновесия и десятичного логарифма константы равновесия синтеза метанола от температуры и давления показаны в графиках (рис.1 и 2). Очевидно, что значение совпадают с приведенными источниками литературы [1].
Выводы:
Рассчитаны летучести СО, Н2 и паров СН3ОН, коэффициенты летучести и констант равновесия для реальных условий в рабочих для цинк-медного катализатора синтеза метанола диапазонах температуры и давления.
Данные оформлены в виде таблицы графика достаточно удобные для технических расчетов процесса синтеза с использованием низкотемпературных катализаторов.
Список литературы:
М.М.Караваев, В.И.Леонов,И.Г.Попов "Технология синтетического метанола" под ред.проф.М.М.Караваева- М.Химия.,1984. - 240с.
Евдокимов А. Н., Курзин А. В. Основы химико-технологических расчетов процессов производства органических веществ: учебное пособие / СПбГТУРП. - СПб. 2014. - 105 с.
Краткий справочник физико-химических величин / под ред. А. Равделя, А. М. Пономарёвой. - 10-е изд., перераб. и доп. - СПб.: «Иван Федоров»,2003. - 240 с.
 Календарь событий
Календарь событий
33-я международная специализированная выставка «Газ. Нефть. Технологии» пройдет с 20 по 23 мая 2025 года в Уфе
Дата проведения: 20.05.-23.05.2025
https://gntexpo.ru/
Интервью
Станислав Митрахович: "Было время, когда и 40 долларов за баррель считалось отличной ценой"